COVID-19, das erhöhte Risiko der Bildung von Blutgerinnseln und mögliche vorbeugende und heilende Maßnahmen
Über Hyperaktivierung der Blutplättchen und des Blutgerinnungssystems, Entstehung einer durch COVID-19 verursachten abnorm erhöhten Blutgerinnbarkeit (Hyperkoagulabilität) und Thromboserisiko.
Die Coronavirus-Epidemie wurde von der Weltgesundheitsorganisation (WHO) am 11. März 2020 zur Pandemie erklärt und fordert seit fast zwei Jahren Menschenleben. Bisher lag der Fokus auf der Eindämmung der Ausbreitung des Virus und der Behandlung der Atemwegssymptome, doch mit der Zeit werden die neurologischen und hämostatischen, also das Blutstillungssystem beeinflussenden Auswirkungen von COVID-19 immer deutlicher. Die unkontrollierte Thrombo-Entzündung spielt in der Pathogenese, also im Verlauf der Erkrankung der durch das SARS-CoV-2-Virus verursachten Coronavirus-Erkrankung (COVID-19) eine wichtige Rolle.
Die klinischen Daten deuten darauf hin, dass die Hyperaktivität der Thrombozyten, also die Hyperaktivität der Blutplättchen schon von Anfang an eine Rolle bei der COVID-19-Pathologie spielt und dass die Blutplättchen eine entscheidende Rolle beim Fortschreiten von COVID-19 haben können. Eine Hyperaktivierung der Blutplättchen und des Gerinnungssystems scheint ein wichtiger Treiber für Entzündungen zu sein und wurde mit einer erhöhten Produktion von Entzündungsproteinen oder dem Schweregrad eines Zytokinsturms bei schweren Fällen von COVID-19 in Verbindung gebracht, bei denen eine disseminierte intravaskuläre Blutgerinnung und eine Hyperaktivität der Blutplättchen mit einer schlechten Prognose und einem erhöhten Sterberisiko zusammenhängen.1
- Ein Zytokinsturm ist eine zu intensive Entzündungsreaktion des Immunsystems, die zu Organversagen und schließlich zum völligen Zusammenbruch des Körpers führen kann. Zytokine sind Moleküle, die der Informationsübertragung zwischen Immunzellen dienen. Normalerweise regulieren sie die Stärke der Immunantwort gegen Krankheitserreger. Eine plötzliche, starke Freisetzung von Zytokinen wird als Zytokinsturm bezeichnet. Wenn bei einer Person ein Zytokinsturm entsteht, produziert ihr Körper übermäßige Mengen von Proteinen, die Entzündungen verursachen. Es ist also nicht der Erreger, der die Organe schädigt, sondern die zu intensive Immunantwort, die die körpereigene Energie völlig verbraucht. Covid-19 kann sich auch negativ auf das Gefäßsystem auswirken, weil diese starke Entzündungsreaktion das Risiko von Blutgerinnseln und dadurch von Herzinfarkten und Thrombosen erhöht. Der Begriff wurde während der Coronavirus-Pandemie im Jahr 2020 geläufig, als man entdeckte, dass der schwere Zustand oder der Tod infizierter Personen häufig nicht durch das Virus oder die Lungenentzündung selbst, sondern durch einen Zytokinsturm verursacht wurde.
- Bei der disseminierten intravaskulären Gerinnung handelt es sich um eine abnorme Aktivierung des Gerinnungssystems innerhalb der Gefäßbahn. Die disseminierte intravaskuläre Gerinnung (DIC) tritt auf, wenn die Aktivierung die vorteilhaften Grenzen des Regulierungssystems verlässt und die Gerinnselbildung im gesamten Gefäßsystem verstreut (disseminiert) ausgelöst wird. Die ungehemmte Blutgerinnung verbraucht die normal verfügbaren Gerinnungsproteine und verursacht so eine schwere Hämophilie. In der Praxis bedeutet dies, dass eine abnorme Gerinnbarkeit und eine abnorme Hämophilie gleichzeitig bestehen.
Während viele durch COVID-19 erkrankte Menschen nur leichte bis mäßige Symptome aufweisen, entwickeln einige schwerwiegende, scheinbar unkontrollierte Entzündungsreaktionen, die zu akuten Lungenverletzungen und hypoxämischem (sauerstoffarmem) Atemversagen führen, was die häufigste Todesursache ist. Die Wechselwirkung zwischen Entzündung und Blutgerinnung - Thromboentzündung - ist gut beschrieben und wurde kürzlich untersucht.2, 3
Die COVID-19-Infektion verursacht Anomalien der Blutgerinnung, die durch eine Erhöhung der gerinnungsfördernden Faktoren (einschließlich Fibrinogen, das für die Blutgerinnung unerlässlich ist) und eine Erhöhung des D-Dimeren-Pegels gekennzeichnet sind, was mit einer höheren Sterblichkeit einhergeht.4, 5
- Prokoagulans: eine Substanz, die für die Koagulation, also die Gerinnung des Blutes notwendig ist.
- Fibrinogen: verursacht die Bildung von Fibrinfasern, die ein Fibrinnetz bilden, das mit den anhaftenden Blutplättchen ein Blutgerinnsel bildet.
- D-Dimer ist ein Proteinprodukt, das während des Gerinnungsprozesses entsteht. Der D-Dimer-Test ist die am weitesten verbreitete und zuverlässigste Labormethode zum Nachweis von Venenthrombosen und Embolien. Er zeigt an, ob ein Gerinnungsprozess im innerhalb der Gefäßbahn zirkulierenden Blut begonnen hat.
Kürzlich veröffentlichte und andere Publikationen erwähnen eine erhöhte Inzidenz venöser thromboembolischer Ereignisse (VTE) bei kritisch erkrankten Patienten, die auf die Intensivstation (IS) eingeliefert werden, aufgrund von COVID-19.
- Bei einer Thromboembolie löst sich ein Teil des Blutgerinnsels (Thrombus) von der Gerinnungsstelle und blockiert den Blutfluss in einem engen Teil des Gefäßsystems.

- Lungenembolie wird in den meisten Fällen durch ein Blutgerinnsel (Thrombus) verursacht, das in einem anderen Teil des Gefäßsystems losgerissen ist und mit dem Blutstrom in die Lunge transportiert wird, was eine Verschließung der Blutgefäße verursacht.
- Die Häufigkeit von Schäden an kleinen Gefäßen oder Arteriolen nimmt mit dem Alter ebenfalls zu, da sich Plaque in den Gefäßwänden ablagert oder die Blutgefäße dünner werden. Dies kann durch Bluthochdruck, Fettleibigkeit, Diabetes, hohen Cholesterinspiegel, Rauchen, Bewegungsmangel usw. beschleunigt werden, kann also unabhängig von einer Coronavirus-Infektion mit zunehmendem Alter auftreten. Je nachdem, wo diese auftreten oder symptomatisch werden, können sie neurologische Probleme (Gleichgewichtsprobleme, Schwindel, geistige Schwäche, wenn sie im Gehirn auftreten), Sehstörungen (wenn sie in der Netzhaut auftreten), Hörprobleme (wenn sie in der Cochlea auftreten) usw. verursachen.
Mikrovaskuläre Thrombosen können in einer Umgebung mit ausgeprägten entzündlichen Läsionen auftreten, einschließlich mononuklearer Zellinfiltrate, virusinfizierter Zellen und diffuser Alveolar, also Lungenbläschenschäden.10
- Inflitrate zeigen eine Veränderung der Gewebe, die zu einem dichteren Gewebebild mit einem angehäuften Muster führt. In diesen Bereichen kann das Infiltrat auf die Ansammlung von Flüssigkeiten (Ödeme), bei Entzündung vermehrten Flüssigkeiten (weiße Blutkörperchen, Proteine, Fremdstoffe) oder Zellen (bösartige Tumore, rote Blutkörperchen) hinweisen, die durch eine Reihe von Krankheiten verursacht werden können. Diese Stoffe lassen sich nicht genau vom Lungengewebe trennen, deshalb spricht man von einer Infiltration.
In den Anleitungen aus aller Welt wird die Verwendung von Standardwerten für Gerinnungstests zur Bestimmung der Dosierung von COVID-19-Antikoagulanzien empfohlen, wie in einer französischen Anleitung, in der eine komplette therapeutische Dosis des Antikoagulans für Patienten mit Fibrinogenwerten > 8 g/L oder D-Dimer-Werten > 3,0 µg/mL empfohlen wird.11
Während Dr. Klok und seine Kollegen berichteten, dass sie 2.850 IE Nadroparin pro Tag verwendeten und Patienten über 100 kg 5.700 IE pro Tag erhielten, lag das durchschnittliche Körpergewicht bei 87 kg ± 16, und einige Patienten in der Studie wogen über 100 kg. Die niederländischen Zentren änderten ihre Praxis nach einem Monat bei der Behandlung von COVID-19-Patienten und erhöhten die Nadroparin-Dosis auf 5700 IE pro Tag in dem einen Zentrum, und auf 5700 IE zweimal täglich in einem anderen Zentrum, unabhängig vom Körpergewicht, was der von Rannuci angewendeten erhöhten Dosis sehr ähnelt.8, 12 Diese erhöhten Dosen sind erforderlich, um den dramatischen Anstieg der gerinnungsfördernden Faktoren (wie Fibrinogen) zu bekämpfen.
- Nadroparin ist ein gerinnungshemmendes Mittel, das in die Arzneimittelgruppe gehört, die als Heparine mit niedrigem Molekulargewicht bezeichnet werden. Nadroparin wurde von Sanofi-Synthélabo entwickelt. Nadroparin wird in der allgemeinen und orthopädischen Chirurgie zur Vorbeugung von thromboembolischen Erkrankungen und zur Behandlung von tiefer Venenthrombose eingesetzt.
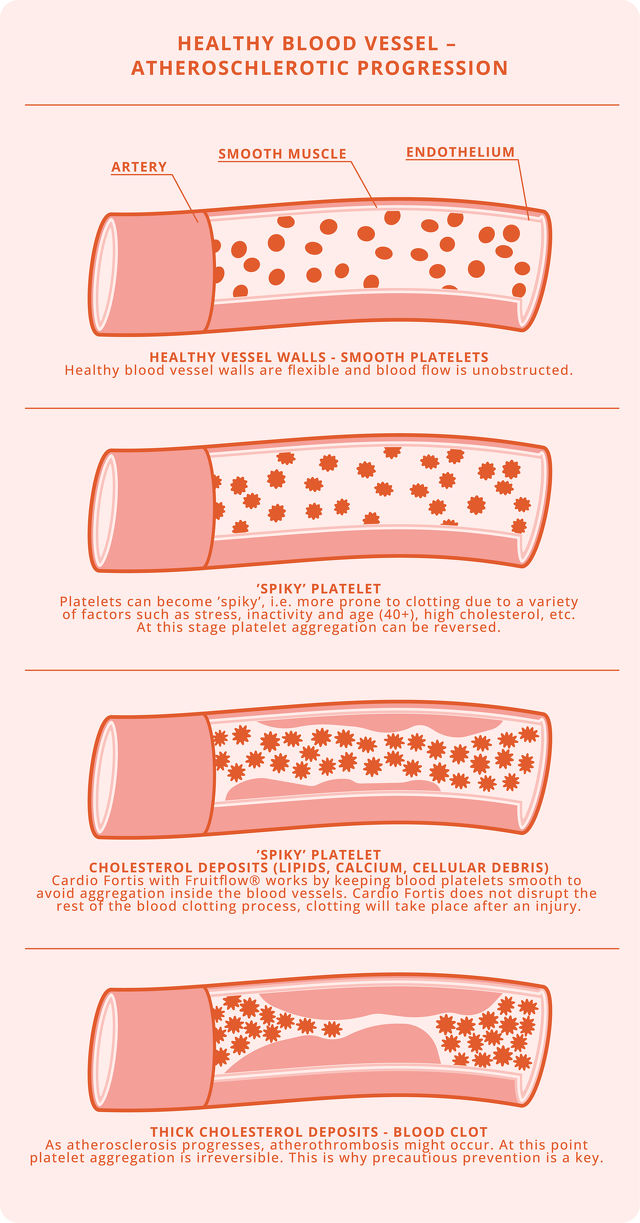
Wenn das Problem schon besteht, ist es schwer dieses zu bekämpfen, daher wird vorgeschlagen, dass eine gezielte Bekämpfung der Thrombozyten-Hyperaktivität in einem frühen Stadium der COVID-19-Infektion stattfindet, dadurch können die immunthrombotischen Komplikationen von COVID-19 verringert und die systemische Entzündungsreaktion abgeschwächt werden. Die Verringerung der anfänglichen Thrombozytenaktivität kann für Gruppen mit höherem Risiko besonders wichtig sein.
Als Alternative zu Thrombozytenaggregationshemmern gilt Fruitflow®, ein aus Tomaten gewonnenes natürliches Nahrungsergänzungsmittel, als eine geeignete Therapie gegen Blutplättchen. Fruitflow® enthält die Aggregation der Thrombozyten verhindernde und entzündungshemmende Verbindungen, die gegen die für COVID-19 spezifischen Mechanismen der Thrombozytenaktivierung wirken.1
Cardio Fortis mit Fruitflow®, Rutin und Resveratrol ist ein sicheres und natürliches Nahrungsergänzungsmittel mit einer Präventionswirkung gegen Thrombose. Lesen Sie in unserem nächsten Blog-Beitrag mehr über die Ergebnisse der Forschung zu diesem Thema.
Quellen
- Platelet hyperactivity in COVID-19: Can the tomato extract Fruitflow® be used as an antiplatelet regime? https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7781513/ Hyperaktivität der Blutplättchen bei COVID-19: Kann Fruitflow®-Tomatenextrakt als Mittel gegen Blutplättchen eingesetzt werden?
- Lillicrap D. Disseminated intravascular coagulation in patients with 2019-nCoV pneumonia. J Thromb Haemost. 2020; 18(4): 786- 787. https://pubmed.ncbi.nlm.nih.gov/32212240/ Lilicrap D. Disseminierte intravaskuläre Gerinnung bei Patienten mit 2019-nCoV-Pneumonie. J Thromb Haemost. 2020; 18(4): 786-787.
- Jackson SP, Darbousset R, Schoenwaelder SM. Thromboinflammation: challenges of therapeutically targeting coagulation and other host defense mechanisms. Blood. 2019; 133: 906- 918. https://pubmed.ncbi.nlm.nih.gov/30642917/ Jackson SP, Darbousset R, Schoenwaelder SM. Thrombo-Entzündung: Herausforderungen bei der therapeutischen Beeinflussung der Gerinnung und anderer Abwehrmechanismen des Wirts. Blood, 2019; 133, 906-918.
- Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020; 395: 1054- 1062. https://pubmed.ncbi.nlm.nih.gov/32171076/ Zhou F, Yu T, Du R und Kollegen. Klinischer Verlauf und Risikofaktoren der Sterblichkeit bei erwachsenen stationären Patienten mit COVID-19 in Vuhan, China: eine retrospektive Studie bestimmter Population. Lancet, 2020; 395: 1054-1062.
- Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020; 323(11): 1061- 1069. https://pubmed.ncbi.nlm.nih.gov/32031570/ Wang D, Hu B, Hu C und Kollegen. 138, Klinische Merkmale eines Krankenhauspatienten mit neuartiger Coronavirus-Infektion und Lungenentzündung in Vuhan, China, im Jahr 2019. JAMA. 2020; 323(11): 1061-1069.
- Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020; 18: 1094- 1099. https://pubmed.ncbi.nlm.nih.gov/32220112/ Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Die Antikoagulationstherapie bei Patienten mit schwerer Covid-19 Krankheit und Koagulopathie verursacht eine Senkung der Sterblichkeit. J Thromb Haemost. 2020; 18: 1094-1099.
- Iba T, Levy JH, Warkentin TE, et al. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost. 2019; 17: 1989- 1994. https://pubmed.ncbi.nlm.nih.gov/31410983/ Iba T, Levy JH, Warkentin TE und Kollegen. Diagnose und Behandlung der durch Sepsis ausgelösten Koagulopathie und der disseminierten intravaskularen Blutgerinnung. J Thromb Haemost. 2019; 17, 1989-1994.
- Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020; 191: 145- 147. https://pubmed.ncbi.nlm.nih.gov/32291094/ Klok FA, Kruip MJHA, van der Meer NJM und andere. Inzidenz thrombotischer Komplikationen bei Patienten mit COVID-19 im kritischen Zustand auf der Intensivstation. Thromb Res. 2020; 191, 145-147
- Lim W, Meade M, Lauzier F, et al. Failure of anticoagulant thromboprophylaxis: risk factors in medical-surgical critically ill patients* Multicenter Study; Randomized Controlled Trial. Crit Care Med. 2015; 43(2): 401- 410. https://pubmed.ncbi.nlm.nih.gov/25474533/ Lim W, Meade M, Lauzier F és mtsai. Versagen der Thromboseprophylaxe mit Antikoagulanzien: Risikofaktoren bei Patienten im kritischen medizinisch-chirurgischen Zustand* Multizentrische Studie; Randomisierter kontrollierter Versuch. Crit Care Med. 2015; 43 (2): 401-410.
- Pulmonary and Cardiac Pathology in Covid-19: The First Autopsy Series from New Orleans https://www.medrxiv.org/content/10.1101/2020.04.06.20050575v1 Pulmonale und kardiale Pathologie bei Covid-19: Die erste Autopsieserie aus New Orleans
- Traitement anticoagulant pour la prevention du risque thrombotiqe chez un patient hospitalise avec COVID-19 et surveillance de l’hemostase propisitions du ghip et du gfht https://www.fichier-pdf.fr/2020/04/03/covid-19-gihp-gfht-3-avril-final-3/ Behandlung mit blutgerinnungshemmenden Mitteln zur Vorbeugung des Thromboserisikos der mit COVID-19 hospitalisierten Patienten und Überwachung der Hämostase von GHIP und GFHT
- Ranucci M, Ballotta A, Di Dedda U, et al. The procoagulant pattern of patients with COVID-19 acute respiratory distress syndrome. J Thromb Haemost. 2020; 18: 1747- 1751. https://pubmed.ncbi.nlm.nih.gov/32302448/ Ranucci M, Ballotta A, Di Dedda U und Kollegen. Prokoagulationsmuster bei Patienten mit akutem COVID-19-Atemnotsyndrom. J Thromb Haemost. 2020; 18: 1747-1751.